发布时间:2024-09-30
NK细胞是一强大的先天免疫细胞,具有其独特性,是肿瘤免疫治疗的理想候选细胞。它们可以从多个来源获得,并且在多个临床研究中证明其安全性。
此外,它们通过受体识别和杀死肿瘤细胞的能力进一步促进了CAR NK细胞的抗肿瘤活性,并可能通过下调CAR靶向抗原来降低复发的风险。虽然最佳
CAR NK细胞生产与疗效仍有待进一步研究验证,其中包括用于免疫治疗的NK细胞的最佳来源、最佳载体系统、与CAR激活最具生物学相关性的信号域
以及理想的体外扩增策略等。尽管如此,早期临床研究结果支持了CAR NK细胞可被纳入目前的癌症治疗中。
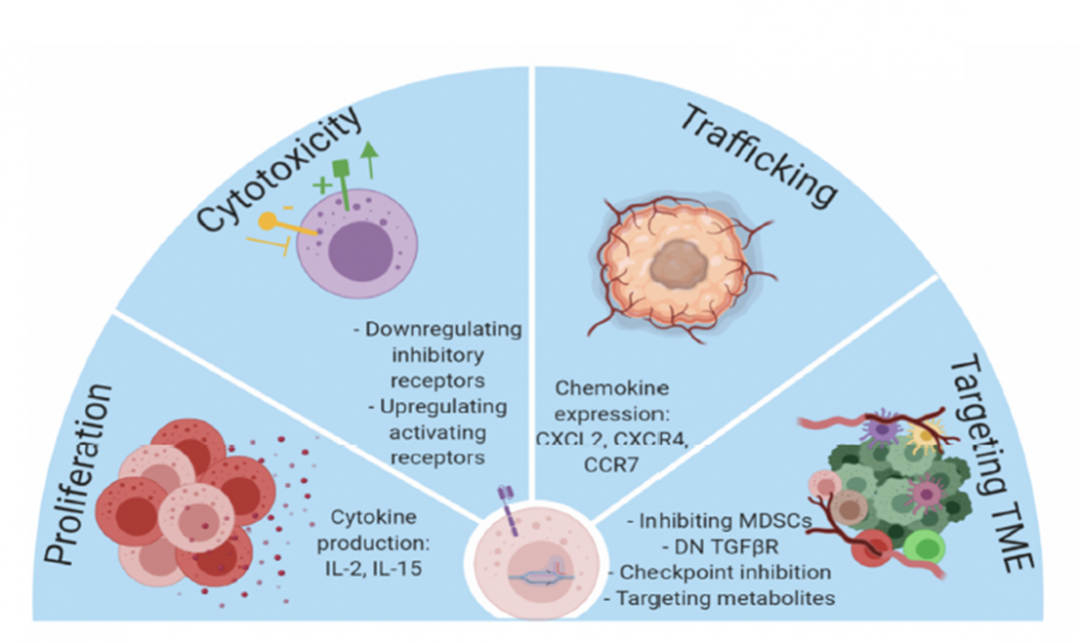
工程化NK细胞是治疗多种癌症的下一代免疫疗法。通过深入了解调节NK细胞功能、运输和肿瘤宿主关系的基本机制,可以开发出一系列具有更大的细
胞效应功能、靶向归巢能力以及在异基因宿主和肿瘤微环境中的存留能力的工程化 NK细胞产品。
持久性,通过表现特定细胞受体增加其细胞毒性,以及针对免疫抑制性肿瘤微环境。
可增强NK-92细胞的体内外抗肿瘤活性。利用逆转录病毒载体构建脐带血来源的NK细胞,使其分泌IL-15,亦可增强其体内增殖和持久性,并表达
CAR-CD19,以提高其体内抗肿瘤活性。另一方法则是通过基因工程使记忆样NK细胞表达CAR,最近在淋巴瘤小鼠模型中显示出强大的体内活性。
以调解免疫检查点为基础的治疗,已经在临床上取得了重大进展。这一进展大部分是通过T细胞实现的,但是针对NK细胞的免疫检查点也可能同
样有效。NKG2A是一种识别MHC-I的抑制性受体,HLA-E。联合应用NKG2A抗体Monalizumab与西妥昔单抗治疗头颈部难治性鳞癌患者的II期试验
中,已见初步成效。使用RNAi技术沉默NK细胞中的NKG2A,从而增强NK细胞对HLA-E表达的癌细胞的细胞毒性。最近,Kamiya et al.利用逆转录
病毒载体表达NKG2A抗体片段后,过继输注的NKG2Anull NK细胞对表达HLA-E的肿瘤具有增强的细胞毒性。
TIGIT是另一种与肿瘤细胞表面CD155结合的NK细胞检查点受体。通过基因敲除或使用单克隆抗体阻断TIGIT已被证明能够释放NK细胞抗肿瘤活
性,从而在临床前小鼠模型中实现更好的肿瘤控制。CIS作为NK细胞中一个重要的检查点分子,在iPSC衍生NK细胞中敲除CIS后上调IL-15表现,
导致IL-15介导的JAK-STAT信号传导路径增强,并在AML异种移植小鼠模型中具有优异的抗肿瘤活性。
靶向肿瘤微环境
针对肿瘤微环境(TME)涉及复杂的免疫抑制网络,包括免疫细胞、基质细胞、细胞因子、代谢物和调节途径。TGF-β是TME中一种重要的免疫抑
制细胞因子。工程化NK细胞表达TGF-βR2,可以中和TGF-β对NK细胞的负面影响,恢复其细胞毒性。另一种策略是针对miRNA: miR-27a-5p,
它在NK细胞中被TGF-β上调。转染miR-27a-5p抑制剂可在体外和体内增强NK细胞效应功能。或使用CRISPR/Cas9敲除人类NK细胞中的
TGF-βR2基因,使NK细胞对TGF-β不敏感,并保持其对AML的效应活性。腺苷(Adenosine)是TME的另一种免疫抑制代谢物,由ATP产生,
在缺氧和应激时由胞外核苷酸酶CD73和CD39产生。
在小鼠黑色素瘤、乳腺癌和纤维肉瘤模型中,阻断高亲和力A2A腺苷受体可促进NK细胞的增殖、成熟和抗肿瘤活性。TME含有大量其他免疫抑
制因子,如IL-10、arginase-1、一氧化氮、前列腺素E2(PGE2)、IDO和活性氧,这些因子可以通过基因工程或联合疗法来靶向以提高对免疫
抑制性TME的抵抗力,例如在过继性细胞移植的NK细胞中表达抗氧化剂。
髓系抑制性细胞 (MDSC)是一种免疫调节细胞,负向调控肿瘤免疫应答。经证明,用ipilimumab (CTLA4抗体)治疗可降低黑色素瘤患者MDSC数
量。因此,将NK细胞免疫治疗与MDSC清除相结合的方法可能会进一步加强抗肿瘤活性。Tregs也是具有吸引力的治疗靶点,因为它们通过不同
的机制抑制NK细胞的活性,包括通过TGF-β的产生和限制NK细胞的IL-2可用性。化疗,如5-FU、cyclophosphamide, doxorubicin 和sunitinib已
被证明能靶向MDSCs和Tregs,并与NK细胞免疫治疗相结合,可获得更好的结果。然而,这些化疗药物保留其广泛的免疫抑制作用,这就要求
使用新技术(如工程化NK细胞)来专一性地靶向并消除MDSCs和Tregs。
提高肿瘤靶向特异性
靶向多种肿瘤类型的NK细胞治疗,特别是针对HLA缺失变体的治疗提供了很大的希望。但是嵌合抗原受体(CAR)在血液肿瘤治疗中改变T细胞
特异性的成功,也激发了科学家们对NK细胞中改造CAR的研究兴趣。最近研究发现NK细胞亚型多样性对CAR功能有影响。所谓的适应性NK细胞,
也称为记忆性NK细胞,具有增加的细胞毒性有效载荷和强大的效应器功能,在第三代CD19特异性CAR的工程化之后显示出最强的功能反应。此
外,CAR工程化不影响NK受体谱,CAR NK细胞在不依赖于CAR靶向抗原存在的情况下,仍保持了识别和溶解肿瘤细胞的固有能力。
因此,CAR NK细胞可能在即使抗原丢失变异的情况下也会生长,同样抑制肿瘤,例如在CAR T细胞治疗期间CD19的下调。这些NK-CAR-iPSC NK
细胞在小鼠异种移植模型中显示了对人类卵巢癌细胞的杀伤作用,包括延长了CAR NK细胞在体内的存活和扩增。有趣的是,直接比较CAR iPSC
-NK细胞和CAR T细胞发现,CAR NK细胞介导的毒性更小,生存率提高。除了CAR介导的特异性外,CD16表达与治疗性单克隆抗体(如Herceptin、
Erbitux和Rituxan)结合时,可以作为一种通用的靶向方法。通过单抗介导的靶向作用,CD16诱导ADCC,可以有效地清除靶细胞。因为CD16在
激活时会脱落,所以已经对其进行了修改,以防止刺激介导的脱落,从而继续传递信号并改善功能。
综上所述,这些研究结果表明,通过不同联合策略来提高NK细胞的内在功能潜能,以及使用优化的信号基序(利用特定的NK细胞信号通路)来增
强NK细胞的内在功能潜能,从而获得更大的临床疗效。在不久的将来,我们将看到一系列用于治疗NK细胞的组合策略,以改善NK细胞的持久性和
转移性,在保持其安全性的同时增强其细胞毒性,并提高其对免疫抑制性肿瘤微环境的抵抗力。
NK MACS® 培养基
培镨生物NK MACS® Medium可支持不同来源的NK细胞在无滋养层下快速扩增,维持NK细胞完整功能(如细胞杀伤作用),并减少非NK细胞增生。
同时亦提供NK MACS GMP级培养基供临床应用。
參考文献:
1. Chimeric antigen receptor (CAR) natural killer (NK)-cell therapy: leveraging the power of innate immunity. Br J Haematol . 2020 Nov 20. doi: 10.1111/bjh.17186.
2. Off-the-shelf cell therapy with induced pluripotent stem cell-derived natural killer cells. Semin Immunopathol. 2019 Jan;41(1):59-68. doi: 10.1007/s00281-018-0721-x.
关注培镨生物,了解更多相关知识