发布时间:2024-09-29
人类多能干细胞(human Pluripotent stem cell, hPSC)应用于细胞治疗潜力是巨大的,超过14种疾病和损伤的细胞疗法已经或即将进入临床试验。hPSC
技术更为复杂的应用也在稳步进展:包括从hPSC中分化造血干细胞治疗白血病和其他血液疾病,生产治疗肝衰竭的类肝器官,为肾衰竭生产类肾器官…
等等。
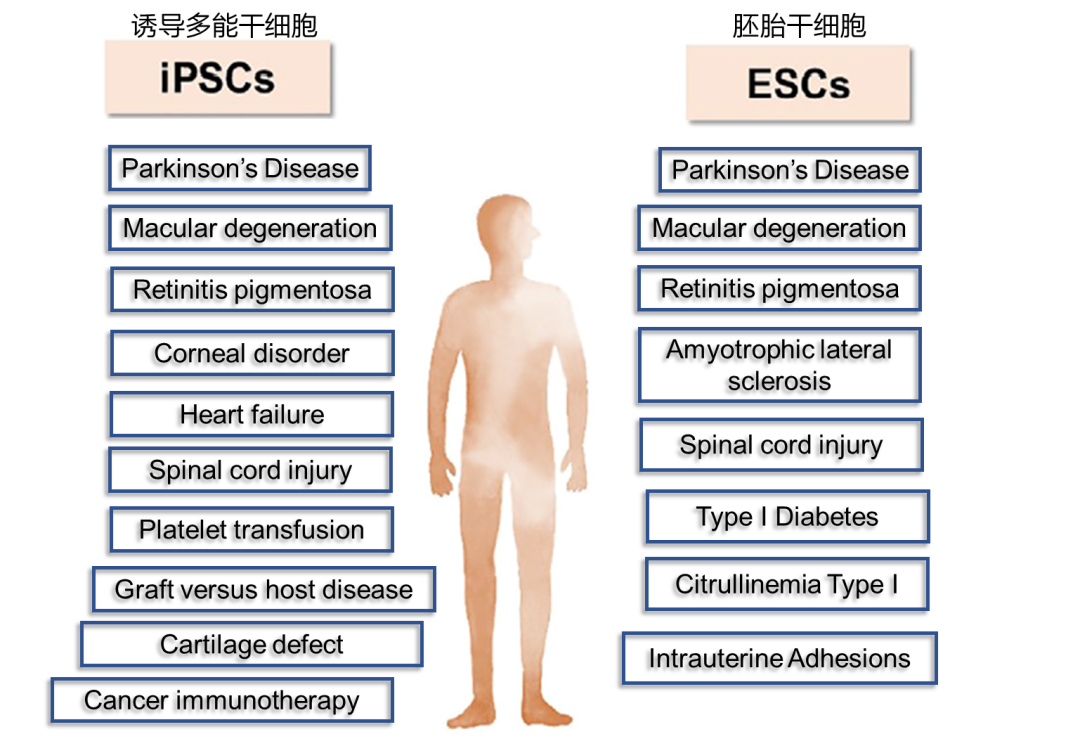
人类多能干细胞临床试验正在或即将进行治疗的疾病列举 (adapted from Yamanaka et al. Cell Stem Cell 27, October 1, 2020)
人类多能干细胞,包括胚胎干细胞(ESCs)和诱导多能干细胞(iPSC)为难治性疾病和不可逆损伤提供了前所未有的疾病治愈机会。然而,我们仍然
面临一些限制多能干细胞使用的实际问题,包括它们固有的致瘤性、免疫原性和异质性。
致瘤性 (Tumorigenicity)
多能干细胞的一个重要优点是它具有无限的增殖潜力,因此我们可以制备数十亿的细胞量及不同细胞类型的供细胞移植。然而,这种特性同时是一把
双刃剑,因为如果细胞在移植后继续增殖,就可能导致肿瘤产生。三种可能致瘤情况如下:
第一,畸胎瘤的形成是hPSC细胞移植最严重的问题。如果未分化和/或未成熟细胞残留在已分化的最终细胞产物中,即使是少数残留的PSCs也可能导
致畸胎瘤的形成。此外,如果移植体内存在特异性分化的干细胞,它们可能由于不正确或不完整的分化而形成肿瘤;如在体内神经系统会产生一种高
度增殖的细胞。因此,发展高效定向细胞分化方法或利用细胞分选,获得高纯度、具安全性的功能性细胞供细胞移植,以防止畸胎瘤和其他肿瘤产生。
Masayo Takahashi及其团队在首次临床移植工作中获得了>95% hiPSC来源的视网膜色素上皮细胞 (RPE)用于老年黄斑变性患者移植。此外, 甚至需要
更严格的细胞纯化程序来达到临床试验的安全标准。Jun Takahashi与其团队使用符合GMP等级的细胞分选仪(MACSQuant® Tyto® ),利用Corin抗
体分选多巴胺能神经前体细胞,进行帕金森氏症细胞移植临床试验。
第二,如果iPSC细胞中的重编程因子仍然活跃,它们也可能会促进肿瘤的发生。这种风险是iPSC特有的。常用的四种重编程因子(Oct4, Sox2, Klf4 &
c-Myc) 都与肿瘤发生有关,尤其是c-Myc,它是人类癌症中最常发生突变的基因之一。经证明通过逆转录病毒介导的四种重编程因子的转染而产生的
iPSCs嵌合小鼠通常会发生肿瘤,主要是来自于c-Myc逆转录病毒的再激活。另外,在使用质粒产生的iPSCs中,EBNA1用于维持重编程因子的游离型表
达 (episomal expression) 亦有致癌风险。因此,在临床细胞治疗中应该谨慎地排除这些致癌的转基因在hiPSC中的不当激活表现。
第三,致瘤性可能是由PSC体外培养过程中发生的基因突变引起的。这种风险对于任何细胞移植前需体外扩增的都很常见。体外扩增细胞的培养不可避
免地会引起基因改变,如染色体异常、基因拷贝数变异和单核苷酸突变。传统上,染色体异常可通过核型分析来监测,一但发现染色体缺失、重复或重
排等异常细胞及被排除不用于细胞治疗和其下游应用。在hESCs和hiPSCs中,染色体1号、12号、17号和20号在长期扩增后常出现重复。具有这种染色体
异常的PSC细胞系即不适用于细胞治疗。
免疫原性 (Immunogenicity)
免疫排斥反应是细胞治疗的另一个关键问题。由患者自身细胞产生的iPSCs提供了前所未有的机会进行自体移植 (autologous transplantation) 以规避免疫
反应。然而,自体iPSCs的免疫原性仍存在争议,归因于潜在的异常基因表达。最近研究发现,线粒体的新突变 (de novo mutations) 被认为是自体iPSCs
新表位抗原 (neoepitopes)的潜在来源。
目前考虑到生产成本(经费与时间),同种异体移植 (allograft) 仍是优于自体移植。在严重或急性的适应症中,包括心力衰竭和脊髓损伤,生产临床级自体
细胞产品的时间过长将不利于这些急性疾病的治疗。传统上,移植排斥反应是通过免疫抑制剂来克服的。另一种减少排斥反应的方法是HLA单倍型匹配,
这是目前广泛应用于造血干细胞移植的方法。数百万捐献者在世界各地的骨髓库中登记在册。脐带血样本也可用于患有白血病和其他血液疾病的患者。
然而,用数千种独特的HLA单倍型制备hPSC系是不现实的。相反地,借助iPSC技术,普遍建议从捐赠者中选择HLA-a、HLA-B和HLA-DR匹配的供体生产
iPSC细胞株,建立储备随时可应用于细胞分化与移植。
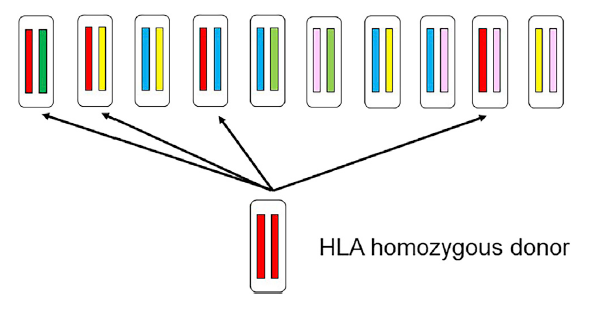
HLA纯合供体的优势。10个个体的HLA单倍型以不同的颜色组合显示(上)。它们没有一个完全相同或理想的组合。来自一个HLA纯合供体的iPSC线显示在
下面板中,10个人中有4个提供HLA匹配。
最近,随着基因编辑技术,特别是CRISPR/Cas9,出现了另一种方法:使HLA基因在多能干细胞中失活。所有的I类MHC,包括HLA-A、HLA-B和HLA-C,可通
过删除其共同成分基因(B2M)而失活。同样,HLA-DP、HLA-DQ和HLA-DR的表达可通过删除对II类MHC基因转录激活因子来抑制,包括CIITA。这种方法被
称为HLA掩蔽 (HLA Cloaking)。
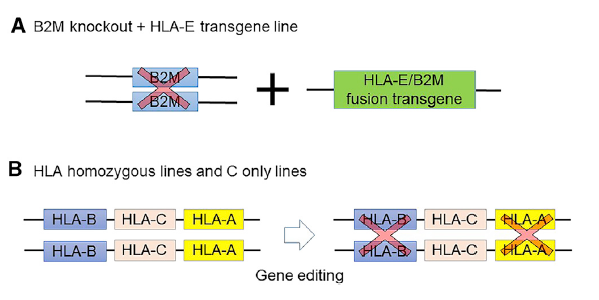
降低同种异体移植免疫原性的两种方法。(A) 通用细胞。所有I类MHC分子均因B2M基因缺失而失活。将HLA-E/B2M融合转基因导入B2M-null-iPSC,以防止内
源性NK细胞的细胞毒性。(B) HLA纯合及HLA-C-only iPSC株系。少数HLA纯合iPSC株可以覆盖大量人群。去除HLA-A和HLA-B,仅保留HLA-C,将覆盖更广泛的
人群。此外,HLA-C将在抵御肿瘤和病毒中发挥作用。
HLA Cloaking的最大优点是仅许少量细胞株即可覆盖全世界人口。一个单一的hiPSC株系有可能成为一种通用的细胞来源;因此在生产细胞供治疗极具吸引力。
首先,它具有成本效益;目前生产GMP级的hESC或hiPSC细胞株至少需要花费20万美元。此外,监管部门将要求对每一个细胞株进行严格的临床前数据。
异质性 (Heterogeneity)
多能干细胞具有两个特性:多能性和无限增殖。然而,每个PSC细胞株并不完全相同。每一个细胞株在细胞形态、生长曲线、基因表达和分化为不同功能细胞的
潜力上都是不同的。这种“异质性”是包括细胞疗法在内,多能干细胞下游应用的障碍。
早期的比较有限数量的hESC和hiPSC系的研究表明,两个hPSC系在基因表达、表观遗传状态和分化潜能方面存在显著差异。然而,后来的研究使用了更多的样本
数来反驳早期的研究研究。Hochedlinger及其团队一项研究表明,基因匹配的hESC和hiPSC是无法区分的。遗传背景是决定基因表达异质性的最大因素。
为了克服异质性,一些研究人员试图将hPSCs的“primed”状态转换为“naïve”状态。hPSCs可以通过转化为“naïve”状态来增强其分化能力。然而对于naïve
hPSCs的一个担忧是遗传完整性 (genetic integrity) 。另一个是遗传印记的丢失 (loss of imprinting) 。这些都会阻碍naïve hPSCs的临床应用。
基于多能干细胞的细胞治疗与应用愈来愈广泛
虽然hPSC的细胞治疗应用仍有以上描述的困难与挑战,但也有一些令人鼓舞的成功案例激励我们积极行动,数百名科学家正继续以高超前沿的技术克服剩
余的障碍。例如,芯片上的器官模型,正在被开发用来预测肿瘤的发生,并且已经确定了可以减少异质性的因素。在不远的将来,我们可以将PSC作为一种
细胞治疗的选择,并且正在发生。
参考文献:
Pluripotent Stem Cell-Based Cell Therapy-Promise and Challenges. Shinya Yamanaka. Cell Stem Cell. 2020 Oct 1;27(4):523-531.
关注培镨生物,了解更多相关知识